本网讯 近日,中南大学生命科学学院刘静教授团队在红细胞生成(erythropoiesis)精细调控机制研究方面取得系列重要进展,相关成果相继发表于《核酸研究》(Nucleic Acids Research)和《基因组学、蛋白质组学与生物信息学》(Genomics, Proteomics & Bioinformatics)。该研究从转录调控与染色质重塑、以及转录后加工与选择性多聚腺苷酸化(APA)两个层面,系统揭示了红系发育过程中的关键分子调控网络,为红系相关疾病的机制解析及潜在干预策略的开发提供了重要的理论依据。
红细胞生成是维持机体氧运输与血红蛋白稳态的关键生理过程,每秒需生成约两百万个红细胞以满足机体需求。红系发育异常与贫血、骨髓增生异常综合征等疾病密切相关,深入解析其调控机制具有重要科学意义和潜在临床价值。转录因子GATA1(位于X染色体上的关键转录因子基因名)被公认为红系分化的核心调控因子,但其转录上游调控网络尚未完全阐明;同时,红系祖细胞BFU-E、CFU-E(红系造血祖细胞的两个关键亚群)的增殖与分化受多层级转录后调控,其关键机制仍有待深入解析。
在发表于《核酸研究》的研究中,研究团队发现染色质重塑因子HLTF(一种解旋酶样转录因子)可直接结合GATA1启动并促进其转录表达。体内外模型证实,HLTF缺失导致GATA1显著下调,进而抑制细胞增殖、诱导凋亡并阻滞红系分化。多组学联合分析显示,HLTF缺失引起红系基因启动子区域染色质可及性降低,并削弱GATA1全基因组结合能力。值得注意的是,HLTF不仅作为GATA1的上游调控因子,还可与GATA1相互作用,招募TAL1(干细胞白血病基因)、BRG1(染色质重塑复合体的核心亚基)等协同调控;同时GATA1反向激活HLTF表达,二者形成正反馈调节环路,共同维持红系分化相关转录程序的稳定性。临床数据分析进一步揭示,HLTF在真性红细胞增多症(PV)等疾病中显著失调,提示其或为红系疾病的潜在分子标志物与治疗靶点。
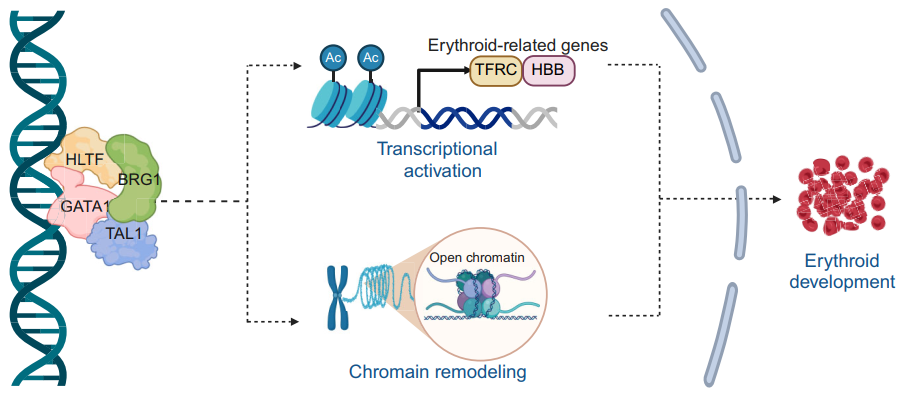
HLTF与GATA1协同激活红细胞发育过程中的转录程序与染色质重塑
另一项发表于《基因组学、蛋白质组学与生物信息学》的研究聚焦红系分化中的选择性多聚腺苷酸化(APA)。团队通过整合不同阶段转录组数据,系统构建了动态APA图谱,发现红系分化早期普遍发生3′UTR(真核生物mRNA分子中位于终止密码下游尾巴之前的非编码区域)缩短,且与细胞周期和RNA调控通路密切相关。PABPC1(多聚腺苷酸结合蛋白胞质1号)被鉴定为介导BFU-E向CFU-E转变过程中APA的关键因子。功能实验证实,PABPC1敲低可抑制红系祖细胞增殖、促进细胞凋亡并阻碍CFU-E集落形成。结合三代全长转录组测序,研究揭示PABPC1通过APA调控TSC22D1(一个编码亮氨酸拉链转录因子的基因)表达,影响红系祖细胞扩增与分化,为红细胞生成的转录后调控机制提供了新见解。
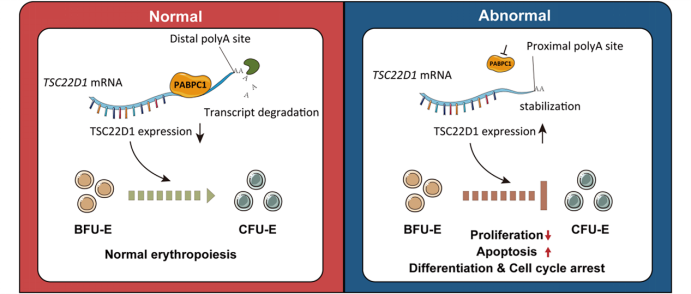
PABPC1通过调控可变多聚腺苷酸化事件影响红系祖细胞增殖
两项研究分别从“转录—染色质”调控与“转录后加工”两个关键层面深化了对红细胞生成多层级调控网络的理解,为红系相关疾病的发生机制研究及精准干预策略的探索提供了重要的理论依据。
(一审:范泓洋 二审:唐潇珺 三审:韩艳)




















